UNIDAD III
LAS SOLUCIONES
En química se conoce con este nombre a todos aquellos compuestos que se encuentran formados por dos compuestos que se conoce con el nombre de soluto o solvente.
EL SOLUTO es el elemento o compuesto que se encuentra con menor proporción en la solución.
EL SOLVENTE entonces es el elemento o compuesto que se encuentra con mayor proporción en la solucion, dependiendo de la cantidad de soluto las soluciones se clasifican de la siguiente manera

CLASIFICACIONES
- DILUIDAS tiene una minima cantidad de soluto en el solvente
- CONCENTRADAS se aumenta la cantidad de soluto pero todavía se disuelve en el solvente
- SATURADAS el soluto ya se disuelve en el solvente y se deposita al fondo del resipiente
- SOBRE SATURADAS se aumenta como la temperatura del solvente y se disuelven exceso de soluto
CONCENTRACIÓN DE LOS SOLUCIONES
Con este termino se mide la cantidad de soluto que se encuentra en una determinada cantidad de solvente. en esta hay 2 unidades de concentración las cuales son
Con este termino se mide la cantidad de soluto que se encuentra en una determinada cantidad de solvente. en esta hay 2 unidades de concentración las cuales son
CLASIFICACION
- UNIDADES FICAS: porsentage de peso (%p)
- UNIDADES QUIMICAS: molaridad (M)
normalidad (N)
FÍSICA DE CONCENTRACIÓN
Estas unidades suelen expresarse en porcentajes, referidos a la masa (gramos) y al volumen (mililitros).
son aquellos en los que se miden en unidades de masa o volumen la cantidad de soluto y disolvente en una determinada cantidad de solvente.
para determinar la concentración se utilizan las siguientes formulas.
Estas unidades suelen expresarse en porcentajes, referidos a la masa (gramos) y al volumen (mililitros).
son aquellos en los que se miden en unidades de masa o volumen la cantidad de soluto y disolvente en una determinada cantidad de solvente.
para determinar la concentración se utilizan las siguientes formulas.
%p=m soluto x 100
M solucion
%v=v soluto x 100
V solucion
Porcentaje de peso= masa soluto x100
Masa solución
porcentaje de volumen= volumen soluto x100
volumen solución
UNIDADES DE QUÍMICA DE CONCENTRACIÓN
Estas unidades se basan en el uso del concepto de MOL. recuerda que un mol indica la cantidad de moléculas presentes en una sustancia y su equivalencia corresponde al peso moléculas del compuesto o peso atómico de los átomos.
Esta unidad nos indica la relación que existe entre los moles de un soluto y de los litros de una solucion que se prepara. para la determinación de la moralidad se utiliza la siguiente formula
UNIDADES DE QUÍMICA DE CONCENTRACIÓN
Estas unidades se basan en el uso del concepto de MOL. recuerda que un mol indica la cantidad de moléculas presentes en una sustancia y su equivalencia corresponde al peso moléculas del compuesto o peso atómico de los átomos.
Esta unidad nos indica la relación que existe entre los moles de un soluto y de los litros de una solucion que se prepara. para la determinación de la moralidad se utiliza la siguiente formula
Mol
L+
moralidad= moles de soluto ° M=n
litros de solución v
NORMALIDAD
El concepto de equivalente gramo o equivalente químico ha sido desarrollado para referirse a ácidos y bases. Así un equivalente gramo es la masa de sustancia (ácido o base) capaz de producir un mol de iones H+ o OH-, según sea el caso. por ejemplo, para el ácido sulfúrico (H2SO4), un euivalente gramo corresponde a el peso molecular dividido entre el numero de H+ capaz de producir, en este caso seria:
1 equiv = 98 gr/ 2H+ = 49 gramos.
NORMALIDAD
El concepto de equivalente gramo o equivalente químico ha sido desarrollado para referirse a ácidos y bases. Así un equivalente gramo es la masa de sustancia (ácido o base) capaz de producir un mol de iones H+ o OH-, según sea el caso. por ejemplo, para el ácido sulfúrico (H2SO4), un euivalente gramo corresponde a el peso molecular dividido entre el numero de H+ capaz de producir, en este caso seria:
1 equiv = 98 gr/ 2H+ = 49 gramos.
La normalidad es la unidad química de la concentración para determina la concentración de ácidos y bases para determinarla, es necesario conocer en primer lugar el concepto de peso equivalente
para determinar el peso equivalente se pueden utilizar una de las siguientes formulas.
peq acido= pm acido peq base = pm base
#de (H) #de OH
peq sal= pm sal
# descargas
LOS ÁCIDOS Y LAS BASES
Desde la Antigüedad se conocen distintas sustancias de características especiales y de gran interés práctico que hoy conocemos como ácidos y bases.
Ácidos y bases son reactivos químicos muy comunes y gran parte de su química se desarrolla en medio acuoso. Las reacciones en las que participan estas especies de denominan reacciones ácido-base, y su estudio requiere la aplicación de los principios del equilibrio químico a disoluciones. En estas reacciones, el disolvente juega un papel muy importante, ya que ácidos y bases intercambian protones con él, es por ello, que también se denominan reacciones de trasferencia de protones.
Desde la Antigüedad se conocen distintas sustancias de características especiales y de gran interés práctico que hoy conocemos como ácidos y bases.
Ácidos y bases son reactivos químicos muy comunes y gran parte de su química se desarrolla en medio acuoso. Las reacciones en las que participan estas especies de denominan reacciones ácido-base, y su estudio requiere la aplicación de los principios del equilibrio químico a disoluciones. En estas reacciones, el disolvente juega un papel muy importante, ya que ácidos y bases intercambian protones con él, es por ello, que también se denominan reacciones de trasferencia de protones.
Estas familias derivan del tema de desproporcionar de una moléculas de agua las soluciones de clasificaciones ácidas o básicas dependiendo de la concentración de 10 de hidrógenos las solución de las soluciones ácidas tienen una concentración de iones de hidrógeno menor a 1x10 mol
y los soluciones básicas tienen una concentración a mayor de 1x10 mol.

POTENCIO DE HIDRÓGENO (PH)
El potencial de hidrógeno, pH, es el término que nos indica la concentración de iones hidrógeno en una disolución. Se trata de una medida de la acidez de la disolución. El término (del francés pouvoir hydrogène, 'poder del hidrógeno') se define como el logaritmo de la concentración de iones hidrógeno, H+, cambiado de signo:
este valor se puede se puede determinar teóricamente utilizando, la sieguen te formula PH= log (h+)
experimentalmente el valor de ph se puede determinar con tiras reactivas
o un aparato que revise el nombre de potencio metro.

QUIMICA ORGANICA
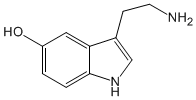
La química orgánica es la disciplina científica que estudia la estructura,Serotoninapropiedades, síntesis y creatividad de compuestos químicos formados principalmente por carbono e hidrógeno, los cuales pueden contener otros elementos, generalmente en pequeña cantidad como oxígeno, azufre, nitrógeno, halógenos, fósforo, silicio.
El término “orgánico” procede de la relación existente entre estos compuestos y los procesos vitales, sin embargo, existen muchos compuestos estudiados por la química orgánica que no están presentes en los seres vivos, mientras que numerosos compuestos inorgánicos forman parte de procesos vitales básicos, sales minerales, metales como el hierro que se encuentra presente en la hemoglobina…. Es la parte de la química que estudia a las compuestos que como elemento principal carbono este elemento se combina con 5 elementos mas para formar mas de 6 millones de compuestos diferente

y los soluciones básicas tienen una concentración a mayor de 1x10 mol.

POTENCIO DE HIDRÓGENO (PH)
El potencial de hidrógeno, pH, es el término que nos indica la concentración de iones hidrógeno en una disolución. Se trata de una medida de la acidez de la disolución. El término (del francés pouvoir hydrogène, 'poder del hidrógeno') se define como el logaritmo de la concentración de iones hidrógeno, H+, cambiado de signo:
pH = -log [H+]
donde [H+] es la concentración de iones hidrógeno en moles por litro. Debido a que los iones H+ se asocian con las moléculas de agua para formar iones hidronio, H3O+, el pH también se expresa a menudo en términos de concentración de iones hidronio.Estos términos se ulizando para representar, la cantidad de inos de hidrógeno que tiene un compuestoeste valor se puede se puede determinar teóricamente utilizando, la sieguen te formula PH= log (h+)
experimentalmente el valor de ph se puede determinar con tiras reactivas
o un aparato que revise el nombre de potencio metro.

QUIMICA ORGANICA
La química orgánica es la disciplina científica que estudia la estructura,Serotoninapropiedades, síntesis y creatividad de compuestos químicos formados principalmente por carbono e hidrógeno, los cuales pueden contener otros elementos, generalmente en pequeña cantidad como oxígeno, azufre, nitrógeno, halógenos, fósforo, silicio.
El término “orgánico” procede de la relación existente entre estos compuestos y los procesos vitales, sin embargo, existen muchos compuestos estudiados por la química orgánica que no están presentes en los seres vivos, mientras que numerosos compuestos inorgánicos forman parte de procesos vitales básicos, sales minerales, metales como el hierro que se encuentra presente en la hemoglobina…. Es la parte de la química que estudia a las compuestos que como elemento principal carbono este elemento se combina con 5 elementos mas para formar mas de 6 millones de compuestos diferente


Comentarios
Publicar un comentario